Grafiet, molecuulformule: C, molecuulgewicht: 12.01, is een vorm van element koolstof, elk koolstofatoom is verbonden door drie andere koolstofatomen (gerangschikt in honingraatzeshoeken) om een covalent molecuul te vormen.Omdat elk koolstofatoom een elektron uitzendt, degenen die vrij kunnen bewegen, is grafiet een geleider.
Grafiet is een van de zachtste mineralen en wordt onder meer gebruikt voor het maken van potloodstiften en smeermiddelen.Koolstof is een niet-metalen element dat zich in de tweede cyclus IVA-groep van het periodiek systeem bevindt.Grafiet ontstaat bij hoge temperaturen.
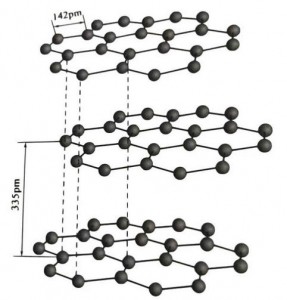
Grafiet is een kristallijn mineraal van koolstofelementen en het kristallijne rooster is een zeshoekige gelaagde structuur.De afstand tussen elke maaslaag is 3,35A en de afstand tussen koolstofatomen in dezelfde maaslaag is 1,42A.Het is een zeshoekig kristalsysteem met een volledig gelaagd decolleté.Het splitsingsoppervlak bestaat voornamelijk uit moleculaire bindingen, minder aantrekkelijk voor moleculen, dus de natuurlijke vlotter is erg goed.
In grafietkristallen vormen de koolstofatomen in dezelfde laag een covalente binding met sp2-hybridisatie, en elk koolstofatoom is verbonden met drie andere atomen in drie covalente bindingen.De zes koolstofatomen vormen een zes-continue ring in hetzelfde vlak, zich uitstrekkend in een lamellenstructuur, waar de bindingslengte van de CC-binding 142 pm is, wat precies binnen het bindingslengtebereik van het atoomkristal ligt, dus voor dezelfde laag , het is een atomair kristal.Koolstofatomen in hetzelfde vlak hebben één p-baan, die elkaar overlappen.Elektronen zijn relatief vrij, gelijk aan vrije elektronen in metalen, dus grafiet kan warmte en elektriciteit geleiden, wat het kenmerk is van metaalkristallen.Dus ook geclassificeerd als metaalkristallen.
De middelste laag grafietkristal is gescheiden door 335 pm en de afstand is groot.Het wordt gecombineerd met de van der Waals-kracht, dat wil zeggen, de laag behoort tot het moleculaire kristal.Omdat de binding van koolstofatomen in dezelfde vlakke laag echter erg sterk is en buitengewoon moeilijk te vernietigen, is het oplospunt van grafiet ook erg hoog en zijn de chemische eigenschappen ervan stabiel.
Gezien zijn speciale bindingsmodus, kan grafiet niet worden beschouwd als een enkel kristal of polykristal, maar wordt grafiet nu algemeen beschouwd als een gemengd kristal.
Posttijd: 31 juli 2023